HiFi zosilňovačový mix TIANSeq
Po prúde
Amplifikácia PCR knižnice NGS, sekvencovanie PCR 1. generácie, amplifikácia PCR, vysoko presné klonovanie, detekcia SNP, miestne špecifická mutácia atď.
Vlastnosti
■ Vysokoúčinná amplifikácia: Zaistite konverzný pomer a znížte amplifikačné cykly.
■ Nízka preferencia: Vyvážená účinnosť amplifikácie pre templáty DNA s rôznym obsahom GC%.
■ Vysoká špecifickosť: S vlastnosťou HotStart a silnou špecifickosťou.
■ Vysoká vernosť: Vernosť je 50 -krát vyššia ako Taq DNA polymeráza.
■ Vysoká citlivosť: Vstup šablóny môže byť až 1 str.
Všetky výrobky je možné prispôsobiť pre ODM/OEM. Podrobnostikliknite na položku Prispôsobená služba (ODM/OEM)
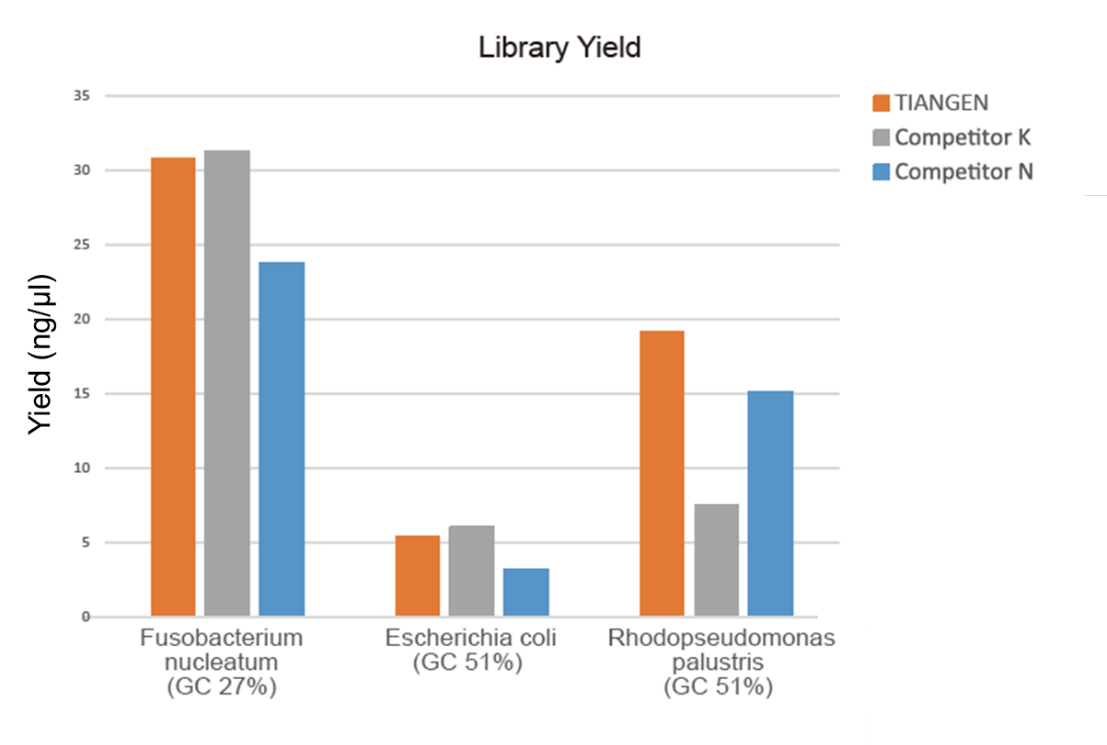 |
Obrázok 1. Obohatenie knižnice genómovej DNA rôznymi pomermi GC (genomický vstup 10 ng, 8 cyklová amplifikácia) sa uskutočňovalo súčasne pomocou TIANSeq HiFi Amplification Mix a HiFi enzýmu od dodávateľa K a N a výťažok knižnice detegoval Agilent 2100. Výsledky ukázali, že HiFi Amplification Mix TIANSeq má vysoký výťažok knižnice so silnou univerzálnosťou pre rôzne obsahy GC a výkon obohacovania knižnice bol lepší ako u iných dodávateľov. |
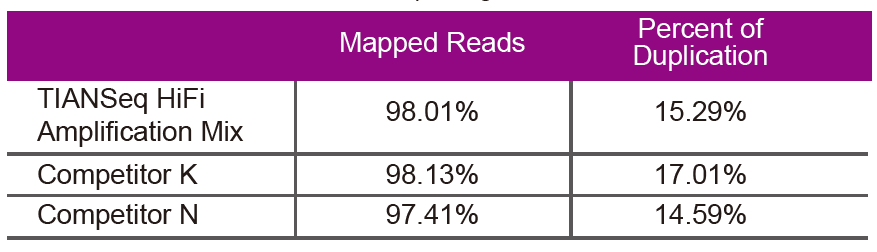 |
Sekvenčné údajeNa amplifikáciu knižnice rovnakej genómovej DNA (vstup genómu je 10 ng) použite TIANSeq HiFi Amplification Mix a HiFi enzým špeciálne používaný na amplifikáciu knižnice NGS od dodávateľa K a N. Po sekvenovaní analyzujte pokrytie a rýchlosť duplikácie knižnice. |
Preferencia GC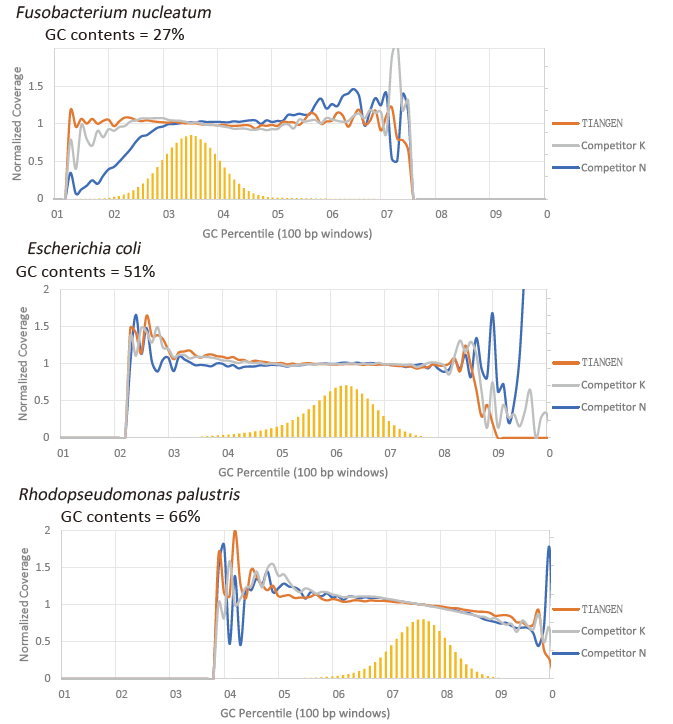 |
Obrázok 2. Amplifikujte genómové knižnice s rôznym obsahom CG pomocou TIANSeq HiFi Amplification Mix a HIFi od dodávateľa K a N. Výsledok ukazuje, že jednotnosť amplifikačnej knižnice TIANSeq HiFi Amplification Mix je dobrá a bez preferencie GC, ktorá je ekvivalentná výsledkom spoločnosti K a o niečo lepšie ako produkty spoločnosti N. Výsledky ukazujú, že pokrytie zosilňovacej knižnice zosilňovača HiFi Amplification Mix TIANSeq HiFi je vysoké, miera duplikácie spĺňa požiadavky a amplifikačný výkon knižnice je ekvivalentný výkonu konkurencie. |
V súčasnej dobe je vysoko výkonná sekvenačná technológia založená predovšetkým na technológii sekvenovania ďalšej generácie. Pretože je dĺžka čítania technológie sekvenovania ďalšej generácie obmedzená, musíme sekvenciu po celej dĺžke rozdeliť na malé fragmentové knižnice. Podľa potrieb rôznych sekvenčných experimentov obvykle volíme sekvenovanie s jedným koncom alebo s dvojitým koncom. V súčasnej dobe sú DNA fragmenty sekvenčnej knižnice ďalšej generácie spravidla distribuované v rozsahu 200-800 bp.

a) DNA má nízku kvalitu a obsahuje inhibítory. Na zamedzenie inhibície aktivity enzýmu používajte vysokokvalitné vzorky DNA.
b) Množstvo vzorky DNA je nedostatočné pri použití metódy bez PCR na konštrukciu knižnice DNA. Keď vstup fragmentovanej DNA prekročí 50 ng, počas postupu výstavby knižnice je možné selektívne uskutočniť pracovný postup bez PCR. Ak je počet kópií knižnice príliš nízky na to, aby sa dal priamo sekvenovať, knižnica DNA sa môže po ligácii adaptéra amplifikovať pomocou PCR.
c) Kontaminácia RNA vedie k nepresnej počiatočnej kvantifikácii DNA V procese purifikácie genómovej DNA môže existovať kontaminácia RNA, čo môže viesť k nepresnej kvantifikácii DNA a nedostatočnému načítaniu DNA počas výstavby knižnice. RNA sa môže odstrániť ošetrením RNázou.
A-1
a) Objavujú sa malé fragmenty (60 bp-120 bp) Malé fragmenty sú zvyčajne fragmenty adaptérov alebo diméry tvorené adaptérmi. Čistenie magnetickými guľôčkami Agencourt AMPure XP môže efektívne odstrániť tieto fragmenty adaptéra a zaistiť kvalitu sekvenovania.
b) V knižnici sa po amplifikácii PCR objavia veľké fragmenty. Veľkosť fragmentu DNA knižnice sa po ligácii adaptéra zvýši o 120 bp. Ak sa fragment DNA zvýši po ligácii adaptéra o viac ako 120 bp, môže to byť spôsobené abnormálnou fragmentačnou amplifikáciou nadmernej amplifikácie PCR. Situácii môže zabrániť zníženie počtu cyklov PCR.
c) Abnormálna veľkosť fragmentov knižnice DNA po ligácii adaptéra Dĺžka adaptéra v tejto súprave je 60 bp. Keď sú dva konce fragmentu ligované s adaptérmi, dĺžka sa zvýši iba o 120 bp. Ak používate iný adaptér, ako je poskytovaný touto súpravou, kontaktujte dodávateľa a poskytnite mu relevantné informácie, ako napríklad dĺžku adaptéra. Zaistite, aby pracovný postup a prevádzka experimentu postupovali podľa krokov popísaných v príručke.
d) Abnormálna veľkosť fragmentu DNA pred ligáciou adaptéra Dôvodom tohto problému môžu byť nesprávne reakčné podmienky počas fragmentácie DNA. Na rôzne vstupy DNA by sa mali použiť rôzne reakčné časy. Ak je vstup DNA vyšší ako 10 ng, odporúčame ako reakčný čas na optimalizáciu zvoliť reakčný čas 12 minút a veľkosť fragmentu produkovaná v tomto čase sa pohybuje predovšetkým v rozmedzí 300-500 bp. Používatelia môžu predĺžiť alebo zmenšiť dĺžku fragmentov DNA na 2 až 4 minúty podľa svojich vlastných požiadaviek, aby optimalizovali fragmenty DNA s požadovanou veľkosťou.
A-2
a) Čas fragmentácie nie je optimalizovaný Ak je fragmentovaná DNA príliš malá alebo príliš veľká, na určenie reakčného času sa riaďte pokynmi pre výber času fragmentácie, ktoré sú uvedené v pokynoch, a tento časový bod použite ako kontrolu, dodatočne nastavte reakčný systém na predĺženie alebo skrátenie o 3 minúty, aby sa dosiahlo presnejšie prispôsobenie času fragmentácie.
A-3
Abnormálna distribúcia veľkosti DNA po fragmentácii
a) Nesprávna metóda rozmrazovania fragmentačného činidla alebo činidlo nie je po rozmrazení úplne zmiešané. Rozmiešajte činidlo 5 × Fragmentation Enzyme Mix na ľade. Po rozmrazení reagent rovnomerne premiešajte jemným pohybom dna skúmavky. Reagenciu nevortexujte!
b) Vstupná vzorka DNA obsahuje EDTA alebo iné znečisťujúce látky. Deplécia iónov soli a chelatačných činidiel v kroku čistenia DNA je obzvlášť dôležitá pre úspech experimentu. Ak je DNA rozpustená v 1 × TE, vykonajte fragmentáciu pomocou metódy uvedenej v návode. Ak je koncentrácia EDTA v roztoku neistá, odporúča sa vyčistiť DNA a rozpustiť v deionizovanej vode pre následnú reakciu.
c) Nepresná počiatočná kvantifikácia DNA Veľkosť fragmentovanej DNA úzko súvisí s množstvom vstupu DNA. Pred fragmentačným spracovaním je potrebná presná kvantifikácia DNA pomocou Qubit, Picogreen a ďalších metód na stanovenie presného množstva DNA v reakčnom systéme.
d) Príprava reakčného systému nie je v súlade s pokynmi Príprava fragmentovaného reakčného systému musí byť vykonaná na ľade striktne podľa pokynov. Aby sa zaistil najlepší účinok, všetky reakčné zložky by sa mali umiestniť na ľad a príprava reakčného systému by sa mala vykonať po úplnom ochladení. Po dokončení prípravy šľahaním alebo pipetovaním dôkladne premiešajte. Nevorte!
1. Nesprávna metóda miešania (vír, násilná oscilácia atď.) Spôsobí abnormálne rozloženie fragmentov knižnice (ako je znázornené na nasledujúcom obrázku), čím ovplyvní kvalitu knižnice. Preto pri príprave reakčného roztoku Fragmentation Mix jemne pipetujte hore a dole, aby ste zamiešali, alebo končekom prsta švihnite a rovnomerne premiešajte. Dávajte pozor, aby ste nezmiešali s vortexom.

2. Na stavbu knižnice sa musí použiť DNA s vysokou čistotou
■ Dobrá integrita DNA: Pás elektroforézy je viac ako 30 kb bez chvosta
■ OD260/230:> 1,5
■ OD260/280: 1,7-1,9
3. Vstupné množstvo DNA musí byť presné Na kvantifikáciu DNA sa odporúča použiť metódy Qubit a PicoGreen, a nie Nanodrop.
4. Musí sa určiť obsah EDTA v roztoku DNA. EDTA má veľký vplyv na fragmentačnú reakciu. Ak je obsah EDTA vysoký, pred nasledujúcim testom je potrebné vykonať čistenie DNA.
5. Fragmentačný reakčný roztok sa musí pripraviť na ľade. Fragmentačný proces je citlivý na reakčnú teplotu a čas (najmä po pridaní zosilňovača). Aby bola zaistená presnosť reakčného času, pripravte reakčný systém na ľade.
6. Fragmentačný reakčný čas musí byť presný. Reakčný čas fragmentačného kroku bude priamo ovplyvňovať veľkosť fragmentových produktov, čím ovplyvní distribúciu veľkosti fragmentov DNA v knižnici.
1. Aký typ vzorky je použiteľný pre túto súpravu?
Vhodným typom vzorky tejto súpravy môže byť celková RNA alebo purifikovaná mRNA s dobrou integritou RNA. Ak sa na konštrukciu knižnice použije celková RNA, odporúča sa najskôr použiť rRNA na odstránenie rRNA (kat. Č. 4992363/4992364/4992391).
2. Môžu byť vzorky FFPE použité na stavbu knižnice s touto súpravou?
MRNA vo vzorkách FFPE bude do určitej miery degradovaná s relatívne slabou integritou. Pri použití tejto súpravy na konštrukciu knižnice sa odporúča optimalizovať čas fragmentácie (skrátiť čas fragmentácie alebo nevykonávať fragmentáciu).
3. Čo by mohlo spôsobiť, že sa v vloženom segmente prejaví mierna odchýlka od kroku výberu veľkosti uvedeného v príručke k produktu?
Voľba veľkosti sa musí vykonávať v prísnom súlade s krokom výberu veľkosti v tejto príručke k produktu. Ak dôjde k odchýlke, dôvodom môže byť to, že magnetické guľôčky nie sú vyvážené na izbovú teplotu alebo nie sú úplne zmiešané, pipeta nie je presná alebo kvapalina zostáva v špičke. Na experiment sa odporúča použiť tipy s nízkou adsorpciou.
4. Výber adaptérov v konštrukcii knižnice
Stavebná súprava knižnice neobsahuje adaptérové činidlo a odporúča sa používať túto súpravu spolu s jednoindexovým adaptérom TIANSeq (Illumina) (4992641/4992642/4992378).
5. QC knižnice
Kvantitatívna detekcia knižnice: Na stanovenie hmotnostnej koncentrácie a molárnej koncentrácie knižnice sa používajú Qubit a qPCR. Prevádzka je striktne v súlade s príručkou produktu. Koncentrácia knižnice bude vo všeobecnosti spĺňať požiadavky sekvenovania NGS. Detekcia distribučného rozsahu knižnice: Použitie Bioanalyzátora Agilent 2100 na detekciu distribučného rozsahu knižnice.
6. Voľba čísla amplifikačného cyklu
Podľa pokynov je počet cyklov PCR 6-12 a počet potrebných cyklov PCR by sa mal zvoliť podľa vstupu vzorky. V knižniciach s vysokým výnosom sa nadmerná amplifikácia zvyčajne vyskytuje v rôznych stupňoch, čo sa prejavuje o niečo väčším píkom po vrchole cieľového rozsahu pri detekcii bioanalyzátora Agilent 2100 alebo detegovaná koncentrácia Qubitu je nižšia ako koncentrácia qPCR. Mierna nadmerná amplifikácia je normálnym javom, ktorý neovplyvňuje sekvenovanie knižnice a následnú analýzu údajov.
7. V detekčnom profile bioanalyzátora Agilent 2100 sa objavujú hroty
Hroty v detekcii bioanalyzátora Agilent 2100 sú spôsobené nerovnomernou fragmentáciou vzoriek, kde bude v určitej veľkosti viac fragmentov, a to bude zrejmejšie po obohatení PCR. V tomto prípade sa odporúča nevykonávať selekciu veľkosti, tj. Nastaviť podmienky fragmentácie na 94 ° C počas 15 minút inkubácie, kde je distribúcia fragmentov malá a koncentrovaná a homogenitu je možné zlepšiť.
Kategórie produktov
PREČO SI VYBRAŤ NÁS
Od svojho založenia naša továreň vyvíja prvotriedne výrobky s dodržaním tohto princípu
najskôr kvality. Naše výrobky získali vynikajúcu povesť v tomto odvetví a dôveryhodnosť medzi novými a starými zákazníkmi.








