2 × mix Taq Platinum PCR
Definícia činnosti
1 jednotka (U) Taq DNA polymerázová aktivita je definovaná ako množstvo enzýmu potrebného na začlenenie 10 nmol deoxynukleotidov do kyselinou nerozpustných látok pri 74 ° C do 30 minút s použitím DNA aktivovaného lososieho spermatu ako templátu/primeru.
Kontrola kvality
Čistota detekciou SDS-PAGE je viac ako 99%; Nebola zistená žiadna aktivita exogénnej nukleázy; Jednokópiový gén v ľudskom genóme by mohol byť účinne amplifikovaný; Pri skladovaní pri izbovej teplote počas jedného týždňa nedochádza k žiadnym významným zmenám aktivity.
Hlavné technické parametre
Má 5'-3 'exonukleázovú aktivitu a 3'-5' exonukleázovú aktivitu a jeho vernosť je vedľa Pfu polymerázy. Rýchlosť predĺženia Taq platinovej polymerázy je rýchlejšia ako polymeráza Pfu a účinnosť zosilnenia je vyššia. Produkty PCR môžu byť priamo ligované na tupý koniec alebo klonované s TA vektorom. Ak je potrebné zlepšiť účinnosť klonovania, odporúča sa najskôr vyčistiť a pred klonovaním do TA vektora pridať 3'-dA previsy.
Jednorúrkový Taq Platinum MasterMix (národná certifikácia špičkových produktov)
■ Taq Platinum MasterMix má zlepšenú špecificitu a citlivosť PCR reakcie a môže amplifikovať komplexné templáty s vysokým obsahom GC, sekundárnou štruktúrou a podobne. Môžu byť amplifikované až 2 kópie cieľovej šablóny, čo zaisťuje presnejšie experimentálne výsledky.
■ Unikátny vzorec Taq Platinum MasterMix robí celý reakčný systém veľmi stabilným a aktivitu neovplyvní opakované zmrazovanie / rozmrazovanie alebo dlhodobé skladovanie pri 4 ° C.
■ Stabilný a účinný vopred pripravený zmiešaný roztok PCR môže urobiť operáciu rýchlou a jednoduchou, čo výrazne zníži intenzitu práce a chyby vzorkovania. V zmesi je tiež zahrnutý vysoko výkonný zosilňovač a optimalizátor PCR, ktorý znižuje požiadavky na podmienky PCR.
■ Tento výrobok má systémy obsahujúce farbivá aj bez farbív. Produkty MasterMix obsahujúce farbivá je možné po PCR priamo elektroforetizovať bez pridania plniaceho pufra.
Aplikácie
Môže nahradiť Pfu polymerázu na amplifikáciu vysoko verných produktov z komplexných templátov, ako sú genómy, a je vhodný na aplikácie, ako je klonovanie expresných génov, miestne špecifické mutácie a analýza jednonukleotidového polymorfizmu (SNP) atď.
Opatrenia pri navrhovaní primerov PCR:
Dĺžka základného náteru je zvyčajne 20-25 mi. Pri vykonávaní dlhého fragmentového PCR by sa však dĺžka priméru mala zvýšiť na 30-35 mi.
■ Neexistuje žiadny komplementárny pár medzi týmito dvoma primermi, najmä pre posledné 3 bázy na 3 'konci.
■ Obsah GC by mal byť 50-60%a vyhnite sa lokálnym GC alebo AT. Aby sa primer a templát stabilne viazali, vyhnite sa štruktúre bohatej na AT na 3 'konci.
■ Vyhnite sa primeru, aby sa vytvorila sekundárna štruktúra.
■ Vyberte dva priméry s teplotami Tm blízko seba.
Výpočet hodnoty Tm primerov pre PCR:
■ Keď je primér menší ako 20 mer: Tm = 2 ° C × (A+T)+4 ° C × (G+C).
■ Keď je primér viac ako 20 mer: Tm = 81,5+0,41 × (GC%)-600/L, kde L je dĺžka základného náteru.
■ Nastavte teplotu žíhania na (Tm-5) ° C.
Vstup PCR primeru
Príslušnú konečnú koncentráciu primerov je možné zvoliť medzi 0,1 uM a 1,0 uM. Príliš nízka koncentrácia priméru vedie k nízkemu výťažku amplifikačných produktov, zatiaľ čo príliš vysoká koncentrácia priméru je náchylnejšia na nešpecifickú amplifikáciu. Obvykle, keď je množstvo templátovej DNA veľké alebo ako templát je použitá komplexná templátová DNA (ako je DNA ľudského genómu), koncentrácia priméru by mala byť nižšia. Keď je množstvo templátovej DNA malé alebo sa ako templát použije jednoduchá templátová DNA (napr. Plazmidová DNA atď.), Koncentrácia priméru by mala byť vyššia.
Všetky výrobky je možné prispôsobiť pre ODM/OEM. Podrobnostikliknite na položku Prispôsobená služba (ODM/OEM)
 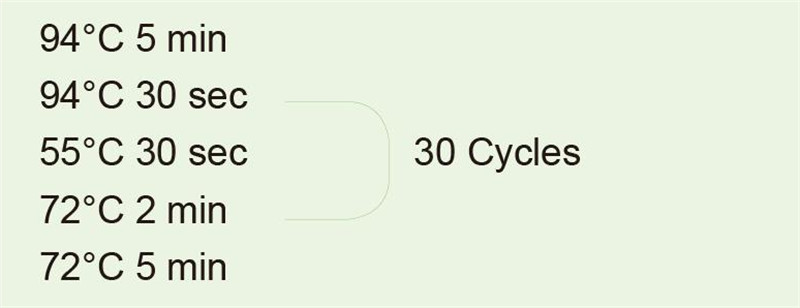 |
Na amplifikáciu 1 kb fragmentu použite genómovú DNA ako templát. Po reakcii PCR odoberte 5 μl na detekciu elektroforézy. |
Šablóna A-1
■ Šablóna obsahuje proteínové nečistoty alebo inhibítory Taq, atď. - Purifikujte templát DNA, odstráňte proteínové nečistoty alebo extrahujte templátovú DNA pomocou purifikačných súprav.
■ Denaturácia templátu nie je úplná - —Vhodne zvýšte denaturačnú teplotu a predĺžte denaturačný čas.
■ Degradácia šablóny ——Pripravte šablónu.
A-2 Primer
■ Nízka kvalita primerov-Znovu syntetizujte primer.
■ Degradácia základného náteru --— Kvôli konzervácii rozdeľte priméry s vysokou koncentráciou do malého objemu. Vyhnite sa viacnásobnému zmrazovaniu a rozmrazovaniu alebo dlhodobému zmrazovaniu v 4 ° C.
■ Nesprávny dizajn primerov (napr. Dĺžka primeru nie je dostatočná, dimér vytvorený medzi primermi atď.) -Prepracovať priméry (vyhnite sa tvorbe diméru priméru a sekundárnej štruktúry)
A-3 Mg2+koncentrácia
■ Mg2+ koncentrácia je príliš nízka —— Správne zvýšte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-4 Teplota žíhania
■ Vysoká teplota žíhania ovplyvňuje viazanie základného náteru a templátu. —— Znížte teplotu žíhania a optimalizujte stav s gradientom 2 ° C.
A-5 Čas predĺženia
■ Krátky čas predĺženia —— Predĺžte čas predĺženia.
Javy: Negatívne vzorky tiež ukazujú pásy cieľovej sekvencie.
A-1 Kontaminácia PCR
■ Krížová kontaminácia cieľovej sekvencie alebo amplifikačných produktov ——————————————————————————————————————————————————————————————————————————————————————————————— opatrné opatrenie: vzorku Činidlá alebo zariadenie by sa mali autoklávovať, aby sa odstránili existujúce nukleové kyseliny, a existencia kontaminácie by sa mala určiť pomocou experimentov s negatívnou kontrolou.
■ Kontaminácia reagencií ——Reagenty rozoberte a skladujte pri nízkej teplote.
A-2 Primer
■ Mg2+ koncentrácia je príliš nízka —— Správne zvýšte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
■ Nesprávny dizajn primeru a cieľová sekvencia má homológiu s necieľovou sekvenciou. ——Re-design primerov.
Javy: PCR amplifikačné pásy nie sú v súlade s očakávanou veľkosťou, buď veľké alebo malé, alebo sa niekedy vyskytujú špecifické amplifikačné pásy aj nešpecifické amplifikačné pásy.
Základný náter A-1
■ Slabá špecificita primeru
——Re-design primer.
■ Koncentrácia priméru je príliš vysoká - —Vhodne zvýšte denaturačnú teplotu a predĺžte denaturačný čas.
A-2 Mg2+ koncentrácia
■ Mg2+ koncentrácia je príliš vysoká —— Správne znížte koncentráciu Mg2+: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-3 Termostabilná polymeráza
■ Nadmerné množstvo enzýmu - Množstvo enzýmu primerane znížte v intervaloch 0,5 U.
A-4 Teplota žíhania
■ Teplota žíhania je príliš nízka —— Vhodne zvýšte teplotu žíhania alebo použite dvojstupňovú metódu žíhania
A-5 PCR cykly
■ Príliš veľa cyklov PCR - Znížte počet cyklov PCR.
Základný náter A-1—— Slabá špecifickosť —— Znovu navrhnite základný náter, zmeňte polohu a dĺžku základného náteru, aby ste zvýšili jeho špecifickosť; alebo vykonajte vnorenú PCR.
DNA templátu A-2
——Šablóna nie je čistá —— Purifikujte templát alebo extrahujte DNA purifikačnými súpravami.
A-3 Mg2+ koncentrácia
——Mg2+ koncentrácia je príliš vysoká —— Správne znížte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-4 dNTP
——Koncentrácia dNTP je príliš vysoká —— Znížte vhodne koncentráciu dNTP
A-5 Teplota žíhania
—— Príliš nízka teplota žíhania —— Vhodne zvýšte teplotu žíhania
A-6 Cykly
——Príliš veľa cyklov ——Optimalizujte počet cyklov

Prvým krokom je výber vhodnej polymerázy. Bežná Taq polymeráza nemôže byť skontrolovaná kvôli nedostatku aktivity 3'-5 'exonukleázy a nesúlad výrazne zníži účinnosť predĺženia fragmentov. Bežná Taq polymeráza preto nemôže účinne amplifikovať cieľové fragmenty väčšie ako 5 kb. Taq polymeráza so špeciálnou modifikáciou alebo iná vysoko verná polymeráza by mala byť zvolená tak, aby sa zlepšila účinnosť extenzie a splnili potreby amplifikácie dlhých fragmentov. Okrem toho amplifikácia dlhých fragmentov tiež vyžaduje zodpovedajúcu úpravu konštrukcie priméru, času denaturácie, času predĺženia, pH pufra atď. K lepšiemu výťažku môžu obvykle viesť priméry s 18 až 24 bp. Aby sa zabránilo poškodeniu templátu, denaturačný čas pri 94 ° C by sa mal skrátiť na 30 sekúnd alebo menej na cyklus a čas na zvýšenie teploty na 94 ° C pred amplifikáciou by mal byť kratší ako 1 minúta. Efektívnu amplifikáciu dlhých fragmentov môže zaistiť aj nastavenie teploty predĺženia na približne 68 ° C a návrh času predĺženia podľa rýchlosti 1 kb/min.
Chybovú rýchlosť amplifikácie PCR je možné znížiť použitím rôznych DNA polymeráz s vysokou vernosťou. Spomedzi všetkých doposiaľ nájdených Taq DNA polymeráz má enzým Pfu najnižšiu chybovosť a najvyššiu vernosť (pozri priloženú tabuľku). Okrem výberu enzýmov môžu vedci ďalej znižovať rýchlosť mutácií PCR optimalizáciou reakčných podmienok vrátane optimalizácie zloženia pufra, koncentrácie termostabilnej polymerázy a optimalizácie počtu cyklov PCR.
Kategórie produktov
PREČO SI VYBRAŤ NÁS
Od svojho založenia naša továreň vyvíja prvotriedne výrobky s dodržaním tohto princípu
najskôr kvality. Naše výrobky získali vynikajúcu povesť v tomto odvetví a dôveryhodnosť medzi novými a starými zákazníkmi.








