Sada FastKing RT (s gDNase)
Vlastnosti
■ Vysoká účinnosť: FastKing RT Enzyme je modifikovaný hydrofóbnym motívom s RT účinnosťou viac ako 95%.
■ Citlivé: Je možné presne identifikovať už 1 ng šablóny.
■ Odolnosť: Schopný reverznej transkripcie komplexných šablón s dokonalou odolnosťou voči nečistotám.
■ Flexibilné: Genomické odstraňovanie DNA a reverzná transkripcia boli dokončené oddelene. Priméry sa zmiešali oddelene v skúmavke, flexibilne, aby sa zmenili ostatné priméry.
Špecifikácia
Typ: Génom modifikovaná reverzná transkriptáza, gDNáza
Procedúry: Dvojkrokové (odstránenie genómovej DNA a RT)
Účinnosť RT:> 95%
Šablóna: 1 ng- 2 μg
Prevádzková doba: ~ 21 min
Aplikácie: reverzne transkribovaná cDNA môže byť použitá v konvenčnej PCR, real time PCR, konštrukcii cDNA knižnice.
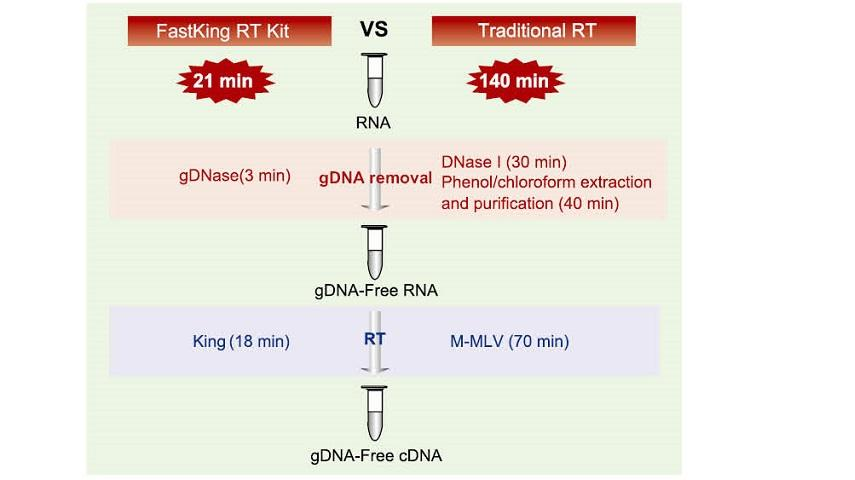
21 minútová reakcia v jednej skúmavke
Dokončenie odstránenia gDNA a efektívneho procesu reverznej transkripcie v tej istej skúmavke trvá iba 21 minút bez toho, aby sa nahradila reakčná skúmavka a nezávislý proces úpravy DNázou I. V porovnaní s tradičnou metódou, ktorá vyžaduje 12-krokovú operáciu a 140-minútovú reakciu, výrazne zjednodušuje operačné kroky a šetrí veľa času operácie.
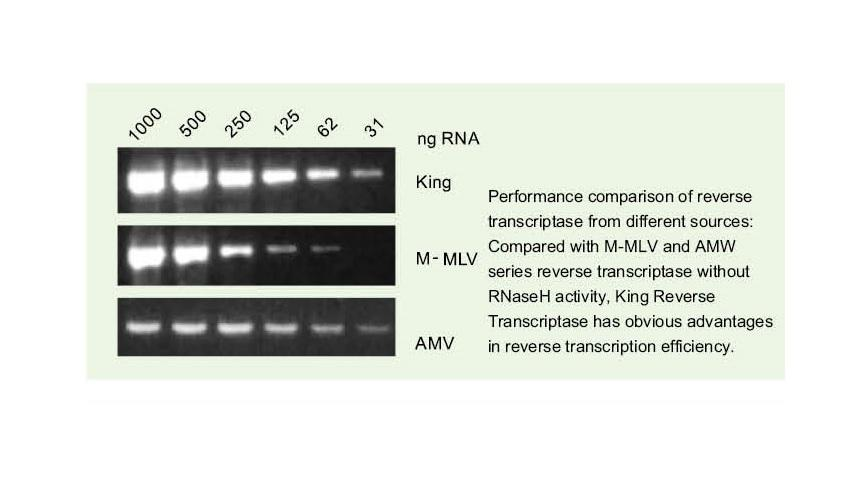
Vynikajúca kvalita King RTase
—— Mimoriadne vysoká účinnosť reverznej transkripcie
—— Účinnosť reverznej transkripcie je viac ako 95%
Všeobecná reverzná transkriptáza má účinnosť reverznej transkripcie 40-60%a výťažok cDNA je možné zvýšiť vyšším množstvom RNA. Kráľova reverzná transkriptáza môže dosiahnuť účinnosť reverznej transkripcie viac ako 95% vďaka svojej jedinečnej vysokej afinite k templátom RNA. Nasledujúce experimenty preto môžu byť uspokojené bez potreby veľkého množstva vstupu RNA, ktorý šetrí RNA a umožňuje vysokú čistotu a vysoký výťažok cDNA.
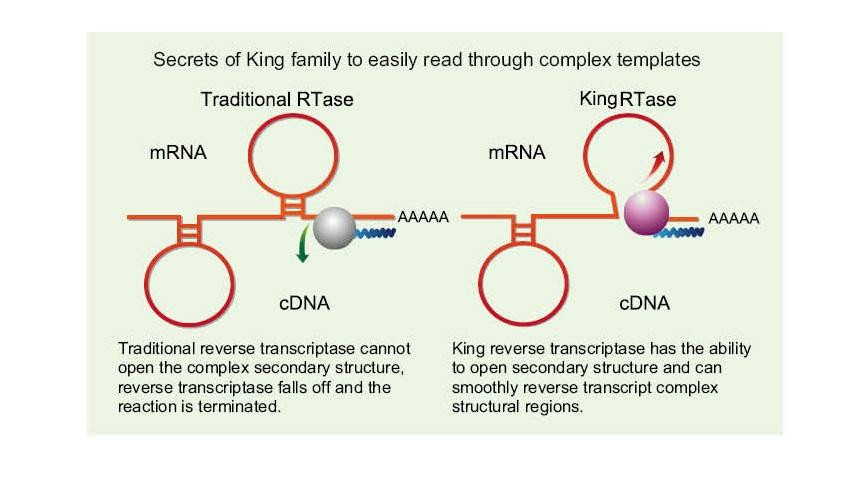
Ľahko si prečítajte zložité šablóny
——Ľahko čítajte vysoké GC a zložité šablóny
Jednovláknová RNA má širokú škálu komplexných oblastí sekundárnej štruktúry v dôsledku vodíkových väzieb medzi vláknami. Bežná reverzná transkriptáza môže viesť k ukončeniu reverznej transkripcie, keď sa stretne so zložitou sekundárnou štruktúrou, takže nemôže úspešne dokončiť syntézu cDNA. Nová generácia Kingovej reverznej transkriptázy má však jedinečnú štruktúrnu doménu, ktorá môže zničiť vodíkovú väzbu medzi vláknami RNA, čím sa otvorí komplexná sekundárna štruktúra RNA a zaistí hladká reverzná transkripcia.
Všetky výrobky je možné prispôsobiť pre ODM/OEM. Podrobnostikliknite na položku Prispôsobená služba (ODM/OEM)
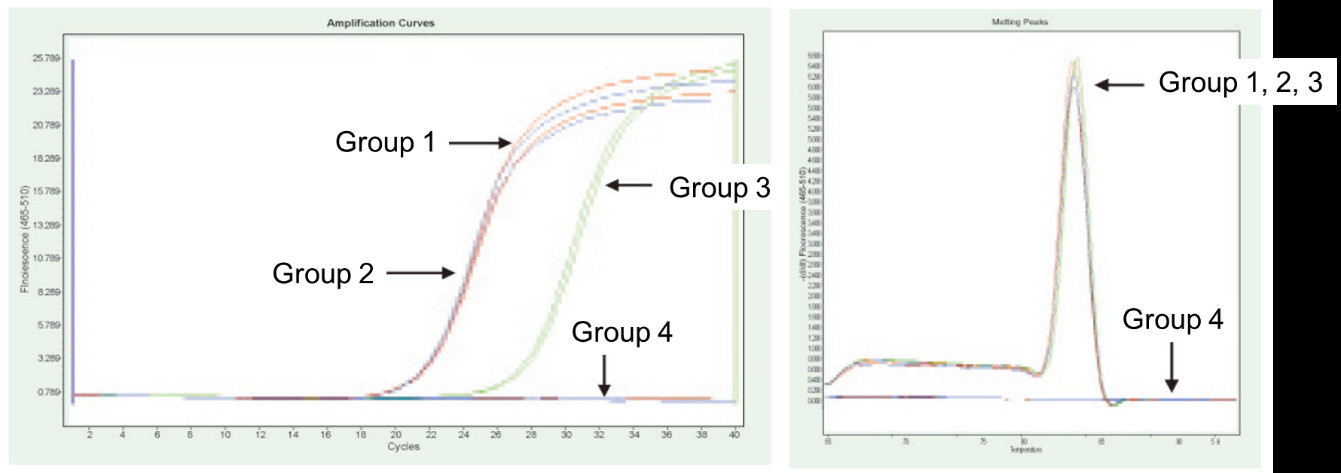 |
Skupina 1: Reverzná transkripcia bez pôsobenia gDNázy; Skupina 2: Žiadne ošetrenie gDNázou a žiadna reverzná transkripcia; Skupina 3: Reverzná transkripcia po ošetrení gDNázou; Skupina 4: Liečba gDNázou bez reverznej transkripcie. Metódy: Fluorescenčná kvantitatívna PCR detekcia génu TNF-alfa (primer navrhnutý na exóne s cDNA alebo genómom ako templátom) s použitím 1 μg RNA bunky Hela (so zvyškom genómu) ako templátu. Výsledky: Ako je znázornené na obrázku, skupina 2 môže odrážať zvyšok genómu v RNA, skupina 3, môže presne odrážať skutočnú úroveň expresie TNF-alfa, skupina 1 má chyby v konečných kvantitatívnych výsledkoch kvôli zvyšku genómu a skupina 4 ukazuje, že súprava FastKing RT dokáže úplne odstrániť zvyškovú genómovú DNA v RNA. |
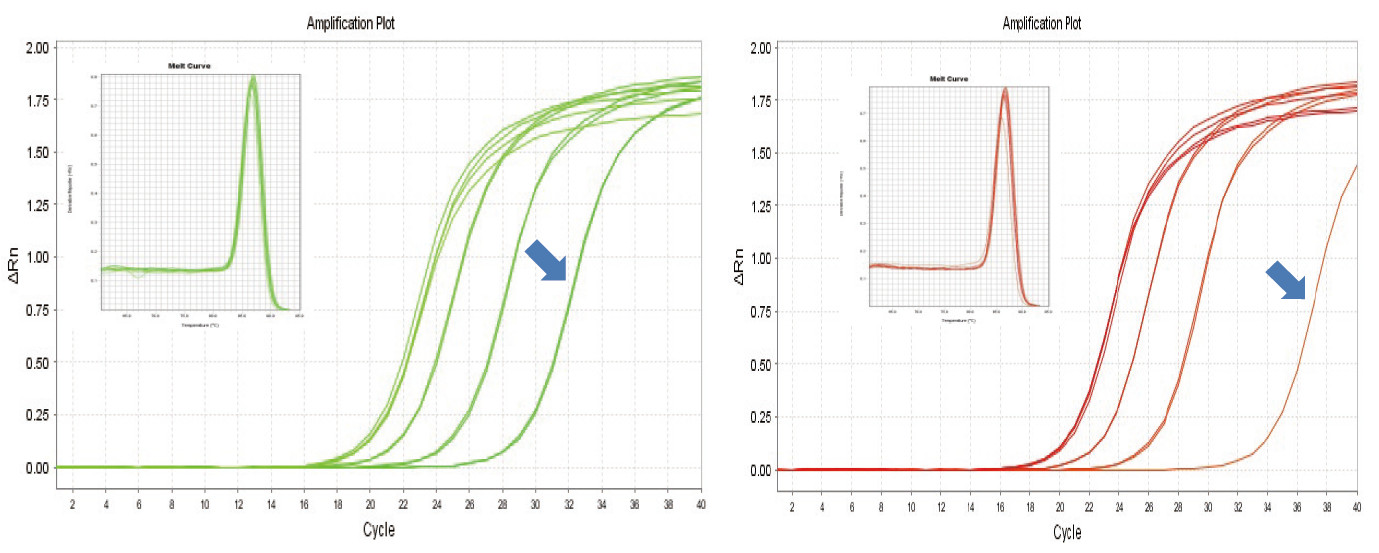 |
Obrázok 1. Reverzná transkripcia myšej RNA sa uskutočnila pomocou súpravy TIANGEN FastKing RT Kit (vľavo) a príslušného produktu dodávateľa A (vpravo), potom sa gén MM5 kvantitatívne amplifikoval pomocou TIANGEN SuperReal PreMix Plus (SYBR Green). Bola analyzovaná amplifikačná krivka a krivka topenia. Vstup RNA bol 1 000 ng, 100 ng, 10 ng a 1 ng. Výsledky ukazujú, že súprava TIANGEN FastKing RT Kit má jasný gradient reverznej transkripcie a nízku hodnotu Ct a má zrejmé výhody pre reverznú transkripciu templátu s nízkym výskytom (1 ng, modrá šípka). |
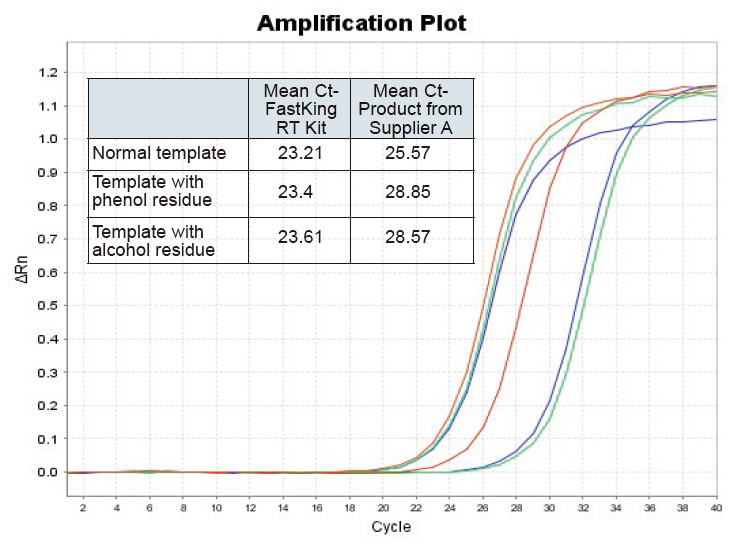 |
Obrázok 2. Reverzná transkripcia normálneho templátu RNA (červená), templátu s veľkým fenolovým zvyškom (zelená) a templátu s alkoholovým zvyškom (modrá) potkanov pomocou súpravy TIANGEN FastKing RT a príslušného produktu dodávateľa A kvantifikujte gény RNC pomocou TIANGEN SuperReal Analyzovali sa PreMix Plus (SYBR Green) a amplifikačné krivky a hodnoty Ct. Výsledky ukazujú, že súprava TIANGEN FastKing RT Kit má najnižšiu kvantitatívnu hodnotu Ct po reverznej transkripcii a vynikajúcu odolnosť voči stresu a má zrejmé výhody pre šablóny s vysokými nečistotami. |
A-1 RNA je degradovaná
——Čistite vysokokvalitnú RNA bez kontaminácie. Materiál, z ktorého sa extrahuje RNA, by mal byť čo najčerstvejší, aby sa zabránilo degradácii RNA. Pred reakciou RT analyzujte integritu RNA na denaturovanom géli. Po extrakcii RNA by sa mal skladovať v 100% formamide. Ak sa použije inhibítor RNázy, teplota zahrievania by mala byť <45 ° C a pH by malo byť nižšie ako 8,0, inak inhibítor uvoľní všetku viazanú RNázu. Okrem toho by sa mal pridať inhibítor RNázy do roztokov obsahujúcich ≥ 0,8 mM DTT.
A-2 RNA obsahuje inhibítory reakcií reverznej transkripcie
—— Inhibítory reverznej transkripcie zahŕňajú SDS, EDTA, glycerol, pyrofosfát sodný, spermidín, formamid, guanidínovú soľ atď. Zmiešajte kontrolnú RNA so vzorkou a porovnajte výťažok s reakciou kontrolnej RNA, aby ste zistili, či existuje inhibítor. Vyzrážanie RNA sa premyje 70% (v/v) etanolom, aby sa odstránili inhibítory.
A-3 Nedostatočné žíhanie primerov použitých na syntézu prvého vlákna cDNA
——Zistite, že teplota žíhania je vhodná pre priméry použité v experimente. Pri náhodných hexaméroch sa odporúča udržiavať teplotu 25 ° C počas 10 minút pred dosiahnutím reakčnej teploty. V prípade génovo špecifických primerov (GSP) vyskúšajte iný GSP alebo prepnite na oligo (dT) alebo náhodný hexamér.
A-4 Malé množstvo počiatočnej RNA
——Zvýšte množstvo RNA. Pre vzorky RNA menšie ako 50 ng je možné pri syntéze cDNA prvého vlákna použiť 0,1 μg až 0,5 μg acetyl BSA
A-5 Cieľová sekvencia nie je exprimovaná v analyzovaných tkanivách.
—— Skúste iné tkanivá.
A-6 PCR reakcia zlyhá
—— V prípade dvojstupňovej RT-PCR nesmie cDNA templát v kroku PCR prekročiť 1/5 reakčného objemu.
A-1 Nešpecifické žíhanie primérov a templátov
—— 3'-koniec primerov by nemal obsahovať 2-3 dG alebo dC. Na syntézu prvého vlákna použite namiesto genetických primérov alebo oligo (dT) génovo špecifické priméry. V prvých cykloch použite vyššiu teplotu žíhania a potom nižšiu teplotu žíhania. Na zlepšenie špecifickosti reakcie použite na polymerázu Taq DNA polymerázu s horúcim štartom.
A-2 Slabý dizajn génovo špecifických primerov
—— Pri návrhu amplifikačného primeru postupujte podľa rovnakých zásad.
A-3 RNA kontaminovaná genómovou DNA
—— Ošetrite RNA DNázou I. stupňa PCR. Na detekciu kontaminácie DNA vytvorte kontrolnú reakciu bez reverznej transkripcie.
A-4 Tvorba diméru priméru
—— Navrhnite priméry bez komplementárnych sekvencií na 3 'konci.
A-5 Príliš vysoký obsah Mg2+ koncentrácia
——Optimalizujte Mg2+ koncentrácia pre každú kombináciu templátu a primeru
A-6 Znečistené cudzou DNA
—— Používajte špičky odolné voči aerosólu a enzýmy UDG.
A-1 Obsah produktu z prvého vlákna je príliš vysoký
—— Znížte množstvo produktu prvého vlákna v konvenčnom reakčnom kroku PCR.
A-2 Príliš vysoké množstvo priméru v reakcii PCR
—— Znížte vstup primeru.
A-3 Príliš veľa cyklov
—— Optimalizujte podmienky reakcie PCR a znížte počet cyklov PCR.
A-4 Príliš nízka teplota žíhania
—— Zvýšte teplotu žíhania, aby ste predišli nešpecifickej iniciácii a predĺženiu.
A-5 Nešpecifická amplifikácia oligonukleotidových fragmentov generovaných degradáciou DNA DNázou-extrahujte vysokokvalitnú RNA, aby ste zabránili kontaminácii DNA.
RT-PCR má reverzne transkribovať RNA do cDNA a potom použiť reverzne transkribovanú cDNA ako templát pre reakciu PCR na amplifikáciu cieľového fragmentu. Vyberte buď náhodné priméry, Oligo dT a génovo špecifické priméry podľa špecifických podmienok experimentu. Všetky vyššie uvedené priméry je možné použiť na krátku eRu -karyotickú bunkovú mRNA bez vlásenkovej štruktúry.
Náhodný primer: Vhodný pre dlhú RNA so štruktúrou vlásenky, ako aj pre všetky druhy RNA, ako napríklad rRNA, mRNA, tRNA atď. Používajú sa hlavne na RT-PCR reakciu jedného templátu.
Oligo dT: Vhodný pre RNA s polyA chvostom (prokaryotická RNA, eukaryotická Oligo dT rRNA a tRNA nemajú chvosty PolyA). Pretože je Oligo dT viazaný na chvost PolyA, vyžaduje sa, aby kvalita vzoriek RNA bola vysoká a dokonca aj malé množstvo degradácie výrazne zníži množstvo syntézy cDNA v plnej dĺžke.
Gén-špecifický primer: Doplnkový k templátovej sekvencii, vhodný pre situácie, kde je známa cieľová sekvencia.
Existujú dva spôsoby:
1. Interná referenčná metóda: cDNA sú teoreticky fragmenty DNA rôznych dĺžok, takže výsledkom elektroforézy je rozmazanie. Ak je početnosť RNA nízka, žiadny produkt sa v elektroforéze neukáže, ale to neznamená, že žiadny produkt nebude amplifikovaný pomocou PCR. Na detekciu cDNA možno všeobecne použiť internú referenciu. Ak má interná referencia výsledky, kvalitu cDNA je možné v zásade zaručiť (v niekoľkých prípadoch, ak je fragment cieľového génu príliš dlhý, môžu existovať výnimky).
2. Ak je známy gén amplifikovaný týmto templátom, môže sa to overiť primermi tohto génu. Amplifikácia vnútornej referencie nemusí nutne znamenať, že s cDNA nie je problém. Pretože interný odkaz má v cDNA vysoký výskyt, je ľahké ho amplifikovať. Ak je cDNA čiastočne degradovaná z rôznych dôvodov, z hľadiska pravdepodobnosti budú výsledky PCR cieľových génov s nízkou početnosťou výrazne ovplyvnené. Aj keď je počet vnútorných referencií stále vysoký, amplifikácia pravdepodobne nebude ovplyvnená.
Čiastočne degraduje RNA. Zistite integritu a vyčistite RNA
Obsahy RNA rôznych druhov môžu byť rôzne, ale vo všeobecnosti by extrahovaná celková RNA mala obsahovať dva čisté pásy 28S a 18S v gélovej elektroforéze a jas prvého pásu by mal byť dvakrát vyšší ako jas druhého pásu. Pás 5S naznačuje, že RNA bola degradovaná a jej jas je úmerný stupňu degradácie. Úspešná amplifikácia vnútornej referencie neznamená, že nie je problém s RNA, pretože vnútorný odkaz je vo veľkom množstve, RNA môže byť amplifikovaná, pokiaľ degradácia nie je závažná. OD260/OD280pomer čistej RNA meraný spektrofotometrom by mal byť medzi 1,9 a 2,1. Malé množstvo proteínových nečistôt v RNA pomer zníži. Pokiaľ hodnota nie je príliš nízka, RT nebude ovplyvnená. To, čo je pre RT najdôležitejšie, je integrita RNA.
Rozšírenie vnútorného referenčného génu môže iba naznačovať, že RT uspel, ale nemusí nevyhnutne súvisieť s kvalitou vlákna cDNA. Pretože vnútorné referenčné fragmenty sú spravidla malé a majú vysokú expresiu, je jednoduchšie byť úspešné pri reverznej transkripcii. Veľkosť a expresia cieľového génu sa však líši od génu k génu. Kvalitu cDNA nemožno posúdiť iba vnútornou referenciou, najmä pre cieľové fragmenty dlhšie ako 2 kb.
Niektoré vzorky majú komplexné sekundárne štruktúry alebo majú bohatý obsah GC alebo sú vzácne s nízkym výskytom. V týchto prípadoch by mala byť zvolená vhodná reverzná transkriptáza podľa veľkosti cieľového fragmentu a vzorky. Pre templáty RNA s vysokým obsahom GC a komplexnou sekundárnou štruktúrou je ťažké otvoriť sekundárnu štruktúru pri nízkej teplote alebo pomocou bežnej reverznej transkriptázy. Pre tieto templáty je možné zvoliť kvantovú reverznú transkriptázu, pretože jej reverzná transkripčná výkonnosť je evidentne lepšia ako u reverznej transkriptázy zo série M-MLV, ktorá dokáže účinne reverzne transkribovať rôzne templáty RNA a transkribovať RNA do prvého vlákna cDNA v maximálnom rozsahu. Pri použití súpravy všeobecnej reverznej transkriptázy môže 20 μl systém účinne reverzne transkribovať iba 1 μg celkovej RNA. Dávajte pozor na maximálnu kapacitu RT sady. Ak sa templát pridá v prebytku, reverzná transkripcia bude zvýhodňovať RNA s vysokým výskytom. Preto je lepšie neprekračovať maximálnu kapacitu systému.
A-1 Zistite, či je RNA vážne degradovaná a či je RT úspešná
Vo všeobecnosti je dôvod zlyhania vnútornej referenčnej amplifikácie často spôsobený vážnou degradáciou RNA. Ďalším možným dôvodom je zlyhanie reverznej transkripcie. Internú referenciu nemožno použiť ako štandard na posúdenie kvality jednoreťazcového cDNA, ale môže sa použiť ako štandard na posúdenie toho, či je reverzná transkripcia úspešná, ak neexistuje problém s kvalitou RNA. Najdôležitejšou vecou v procese reverznej transkripcie je udržiavať konštantnú teplotu a konštantný reakčný systém, aby sa zlepšila účinnosť reakcie.
A-2 Zistite, či sú primery na amplifikáciu interných referenčných génov spoľahlivé a či existujú problémy s činidlami používanými v PCR.
Na účely relatívnej kvantifikácie musí byť RNA kvantifikovaná pred reverznou transkripciou, ktorá je tiež potrebná v mnohých súpravách reverznej transkripcie, napríklad kvantifikujte vstup RNA ako 1 μg. Pretože reverzne transkribovaná cDNA je zmiešaný roztok, vrátane RNA, oligo dT, enzýmu, dNTP a dokonca aj malého zvyšku DNA, dôjde k odchýlke, takže nie je možné presne kvantifikovať cDNA. Preto je potrebná kvantifikácia RNA. Vzhľadom na to, že účinnosť reverznej transkripcie je u rôznych vzoriek rovnaká, množstvo získanej cDNA by malo byť rovnaké a kvantitatívna analýza môže ukázať porovnanie úrovní expresie rôznych génov v rovnakom množstve celkovej RNA. Pri vykonávaní relatívnej fluorescenčnej kvantitatívnej PCR nemusí byť kvantitatívna cDNA po reverznej transkripcii potrebná, pretože vnútorný referenčný gén môže pôsobiť ako referenčný.
Súvisí to predovšetkým s génmi a reverzná transkripcia dlhého fragmentu nie je pre väčšinu génov uskutočniteľná. Po prvé, účinnosť reverznej transkripcie je oveľa nižšia ako účinnosť PCR. Za druhé, oblasť bohatá na GC a sekundárna štruktúra mnohých génov obmedzujú reverznú transkripciu aj PCR. Nakoniec je ťažké súčasne zaručiť vernosť a účinnosť amplifikácie PCR. V procese reverznej transkripcie nikto nemôže zaručiť získanie dlhého fragmentu pre gény s nízkou kópiou, najmä pomocou oligo dT. Pokiaľ ide o 5 'UTR s väčším GC, je to ešte ťažšie. Preto je stále rozumnou metódou reverzný transkript s náhodnými primermi, nájdenie prirodzených štiepnych miest v cieľovom fragmente, amplifikácia segmentmi a potom uskutočnenie reštrikčného štiepenia a ligácie. Vo všeobecnosti je ťažké priamo amplifikovať fragmenty väčšie ako 2 kb, ale nie je vždy nemožné získať: 1. V prvom rade zaručte integritu RNA/mRNA a uprednostňuje sa extrakcia TRIZOL. 2. Súpravu M-MLV RT-PCR je možné použiť priamo. Predĺžte čas žíhania a správne zvýšte počet cyklov v procese amplifikácie. Alternatívne je možné použiť vnorenú PCR alebo najskôr vykonať jednu alebo dve reakcie s príslušne predĺženou denaturáciou a predĺžením pred normálnou amplifikáciou PCR, čo môže pomôcť predĺžiť fragmenty. Dávajte pozor na vernosť polymerázy. 3. Long Taq je možné použiť v PCR na získanie ideálnych výsledkov. 4. Na aplikáciu expresie proteínov by sa mala použiť polymeráza s vysokou vernosťou.
TIANGEN ponúka dva druhy reverznej transkriptázy: Quant/King RTase a TIANScript M-MLV. Hlavným rozdielom medzi nimi je vstupné množstvo šablón. Quant je unikátna reverzná transkriptáza, ktorá sa líši od bežne používaného M-MLV odvodeného z vírusu myšej leukémie Moloney. Quant je nová vysoko účinná reverzná transkriptáza rekombinantne exprimovaná inžinierstvom Escherichia coli. Quant je vhodný na amplifikáciu 50 ng-2 μg RNA s vysokou aktivitou reverznej transkripcie a vysokým výťažkom. V porovnaní s bežným MMLV alebo AMV je Quantovou najväčšou charakteristikou to, že má veľmi silnú afinitu k RNA templátom a môže zvrátiť transkriptové komplexné templáty bez denaturácie pri vysokej teplote. Pri šablónach s vyšším obsahom GC je reverzná účinnosť vyššia. Táto reverzná transkriptáza má však aktivitu RNázy H, ktorá môže ovplyvniť dĺžku produktu cDNA (vhodné pre templáty <4,5 kb). Na konvenčnú reverznú transkripciu sa odporúča reverzná transkriptáza TIANScript MMLV. Táto RTáza je modifikovaný enzým s veľmi slabou aktivitou RNázy H, ktorý je vhodný na dlhú (> 5 kb) syntézu cDNA.
Jednokroková reverzná transkripcia a PCR amplifikácia sa dokončia v tej istej skúmavke bez otvorenia krytu skúmavky medzi syntézou cDNA a amplifikáciou, čo pomáha znižovať kontamináciu. Pretože všetky získané vzorky cDNA sú použité na amplifikáciu, citlivosť je vyššia, s minimom 0,01 pg celkovej RNA. Na úspešný jednokrokový RTPCR sa na iniciáciu syntézy cDNA spravidla používajú génovo špecifické priméry. Dvojkroková metóda, konkrétne reverzná transkripcia a PCR amplifikácia, sa uskutočňuje v dvoch krokoch. Najprv sa vykoná reverzná transkripcia z templátu RNA na získanie cDNA a získaná cDNA sa podrobí jednej alebo viacerým rôznym reakciám PCR. Dvojkroková metóda môže používať oligo (dT) alebo náhodné priméry na vedenie syntézy prvého vlákna cDNA a môže reverzne transkribovať všetky informácie o mRNA zo špecifickej vzorky.
Kategórie produktov
PREČO SI VYBRAŤ NÁS
Od svojho založenia naša továreň vyvíja prvotriedne výrobky s dodržaním tohto princípu
najskôr kvality. Naše výrobky získali vynikajúcu povesť v tomto odvetví a dôveryhodnosť medzi novými a starými zákazníkmi.










