Sada na extrakciu a zosilnenie plodín GMO
Vlastnosti
■ Široká použiteľnosť: Táto súprava môže extrahovať vysokokvalitnú genómovú DNA z piatich hlavných plodín GMO.
■ Jednoduché a rýchle: Extrakciu genómovej DNA plodín GMO je možné vykonať do 2 hodín. Nie sú potrebné veľké chladiace odstredivky, nízke požiadavky na nástroje a vybavenie. Vhodný na rýchlu extrakciu genómovej DNA plodín GMO na všetkých úrovniach výskumných inštitúcií.
■ Vysoká účinnosť a špecifickosť: Unikátny pufer protilátkovo modifikovanej Taq polymerázy zaisťuje efektívnu polymerázovú amplifikáciu, ktorá je špecifickejšia ako normálna Taq polymeráza.
Aplikácie
Súprava môže extrahovať vysokokvalitnú genómovú DNA z hlavných plodín GMO, ako je pšenica, kukurica, ryža, bavlna a sója, a vykonávať transgénnu PCR detekciu na plodinách GMO.
Všetky výrobky je možné prispôsobiť pre ODM/OEM. Podrobnostikliknite na položku Prispôsobená služba (ODM/OEM)
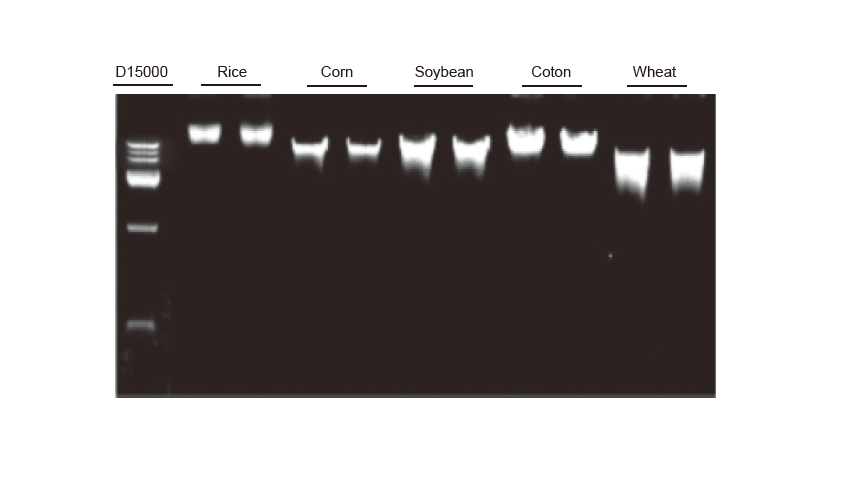 |
Extrakcia genómovej DNA Extrakcia genómovej DNA sa uskutočnila na 100 mg listoch ryže, kukurice, sóje, bavlny a pšenice. Experiment sa opakoval dvakrát. Do jedného pruhu boli nanesené 3 μl DNA z celkových 100 μl eluentov. Koncentrácia agarózového gélu bola 2%. Elektroforéza sa uskutočňovala pri 6 V/cm počas 20 minút. D15000: Marker DNA TIANGEN D15000. |
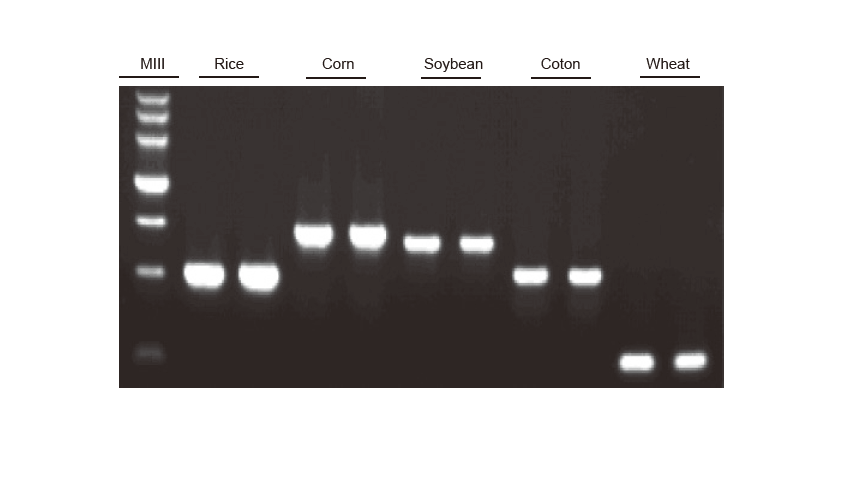 |
Detekcia PCR Genomická DNA z ryže, kukurice, sóje, bavlny a pšenice bola amplifikovaná. Experiment sa opakoval dvakrát. Na jeden pruh sa naložilo 6 μl z celkového 20 μl reakčného systému. Koncentrácia agarózového gélu bola 2%. Elektroforéza sa uskutočňovala pri 6 V/cm počas 20 minút. D15000: Marker DNA TIANGEN D15000. |
Šablóna A-1
■ Šablóna obsahuje proteínové nečistoty alebo inhibítory Taq, atď. - Purifikujte templát DNA, odstráňte proteínové nečistoty alebo extrahujte templátovú DNA pomocou purifikačných súprav.
■ Denaturácia templátu nie je úplná - —Vhodne zvýšte denaturačnú teplotu a predĺžte denaturačný čas.
■ Degradácia šablóny ——Pripravte šablónu.
A-2 Primer
■ Nízka kvalita primerov-Znovu syntetizujte primer.
■ Degradácia základného náteru --— Kvôli konzervácii rozdeľte priméry s vysokou koncentráciou do malého objemu. Vyhnite sa viacnásobnému zmrazovaniu a rozmrazovaniu alebo dlhodobému zmrazovaniu v 4 ° C.
■ Nesprávny dizajn primerov (napr. Dĺžka primeru nie je dostatočná, dimér vytvorený medzi primermi atď.) -Prepracovať priméry (vyhnite sa tvorbe diméru priméru a sekundárnej štruktúry)
A-3 Mg2+koncentrácia
■ Mg2+ koncentrácia je príliš nízka —— Správne zvýšte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-4 Teplota žíhania
■ Vysoká teplota žíhania ovplyvňuje viazanie základného náteru a templátu. —— Znížte teplotu žíhania a optimalizujte stav s gradientom 2 ° C.
A-5 Čas predĺženia
■ Krátky čas predĺženia —— Predĺžte čas predĺženia.
Javy: Negatívne vzorky tiež ukazujú pásy cieľovej sekvencie.
A-1 Kontaminácia PCR
■ Krížová kontaminácia cieľovej sekvencie alebo amplifikačných produktov ——————————————————————————————————————————————————————————————————————————————————————————————— opatrné opatrenie: vzorku Činidlá alebo zariadenie by sa mali autoklávovať, aby sa odstránili existujúce nukleové kyseliny, a existencia kontaminácie by sa mala určiť pomocou experimentov s negatívnou kontrolou.
■ Kontaminácia reagencií ——Reagenty rozoberte a skladujte pri nízkej teplote.
A-2 Primer
■ Mg2+ koncentrácia je príliš nízka —— Správne zvýšte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
■ Nesprávny dizajn primeru a cieľová sekvencia má homológiu s necieľovou sekvenciou. ——Re-design primerov.
Javy: PCR amplifikačné pásy nie sú v súlade s očakávanou veľkosťou, buď veľké alebo malé, alebo sa niekedy vyskytujú špecifické amplifikačné pásy aj nešpecifické amplifikačné pásy.
Základný náter A-1
■ Slabá špecificita primeru
——Re-design primer.
■ Koncentrácia priméru je príliš vysoká - —Vhodne zvýšte denaturačnú teplotu a predĺžte denaturačný čas.
A-2 Mg2+ koncentrácia
■ Mg2+ koncentrácia je príliš vysoká —— Správne znížte koncentráciu Mg2+: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-3 Termostabilná polymeráza
■ Nadmerné množstvo enzýmu - Množstvo enzýmu primerane znížte v intervaloch 0,5 U.
A-4 Teplota žíhania
■ Teplota žíhania je príliš nízka —— Vhodne zvýšte teplotu žíhania alebo použite dvojstupňovú metódu žíhania
A-5 PCR cykly
■ Príliš veľa cyklov PCR - Znížte počet cyklov PCR.
Základný náter A-1—— Slabá špecifickosť —— Znovu navrhnite základný náter, zmeňte polohu a dĺžku základného náteru, aby ste zvýšili jeho špecifickosť; alebo vykonajte vnorenú PCR.
DNA templátu A-2
——Šablóna nie je čistá —— Purifikujte templát alebo extrahujte DNA purifikačnými súpravami.
A-3 Mg2+ koncentrácia
——Mg2+ koncentrácia je príliš vysoká —— Správne znížte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-4 dNTP
——Koncentrácia dNTP je príliš vysoká —— Znížte vhodne koncentráciu dNTP
A-5 Teplota žíhania
—— Príliš nízka teplota žíhania —— Vhodne zvýšte teplotu žíhania
A-6 Cykly
——Príliš veľa cyklov ——Optimalizujte počet cyklov

Prvým krokom je výber vhodnej polymerázy. Bežná Taq polymeráza nemôže byť skontrolovaná kvôli nedostatku aktivity 3'-5 'exonukleázy a nesúlad výrazne zníži účinnosť predĺženia fragmentov. Bežná Taq polymeráza preto nemôže účinne amplifikovať cieľové fragmenty väčšie ako 5 kb. Taq polymeráza so špeciálnou modifikáciou alebo iná vysoko verná polymeráza by mala byť zvolená tak, aby sa zlepšila účinnosť extenzie a splnili potreby amplifikácie dlhých fragmentov. Okrem toho amplifikácia dlhých fragmentov tiež vyžaduje zodpovedajúcu úpravu konštrukcie priméru, času denaturácie, času predĺženia, pH pufra atď. K lepšiemu výťažku môžu obvykle viesť priméry s 18 až 24 bp. Aby sa zabránilo poškodeniu templátu, denaturačný čas pri 94 ° C by sa mal skrátiť na 30 sekúnd alebo menej na cyklus a čas na zvýšenie teploty na 94 ° C pred amplifikáciou by mal byť kratší ako 1 minúta. Efektívnu amplifikáciu dlhých fragmentov môže zaistiť aj nastavenie teploty predĺženia na približne 68 ° C a návrh času predĺženia podľa rýchlosti 1 kb/min.
Chybovú rýchlosť amplifikácie PCR je možné znížiť použitím rôznych DNA polymeráz s vysokou vernosťou. Spomedzi všetkých doposiaľ nájdených Taq DNA polymeráz má enzým Pfu najnižšiu chybovosť a najvyššiu vernosť (pozri priloženú tabuľku). Okrem výberu enzýmov môžu vedci ďalej znižovať rýchlosť mutácií PCR optimalizáciou reakčných podmienok vrátane optimalizácie zloženia pufra, koncentrácie termostabilnej polymerázy a optimalizácie počtu cyklov PCR.
Kategórie produktov
PREČO SI VYBRAŤ NÁS
Od svojho založenia naša továreň vyvíja prvotriedne výrobky s dodržaním tohto princípu
najskôr kvality. Naše výrobky získali vynikajúcu povesť v tomto odvetví a dôveryhodnosť medzi novými a starými zákazníkmi.








