Súprava TIANcombi DNA Lyse & Det PCR
Vlastnosti
■ Jednoduché a rýchle: DNA z rôznych tkanív je možné extrahovať za 5 minút bez potreby mletia tekutým dusíkom.
■ Široké použitie: Použiteľné na listy rastlín, semená, tkanivá zvierat, vzorky krvi (čerstvá krv, antikoagulácia, krvné zrazeniny, vysušené krvavé škvrny atď.), Kvasinky a baktérie.
■ Vysoká kompatibilita: Činidlo PCR je vhodné na amplifikáciu DNA extrahovanej z rôznych zdrojov vzoriek.
Aplikácie
■ Génová detekcia: Ideálna voľba pre rozsiahlu detekciu génov.
Dôležité poznámky
■ Pri vzorkách obsahujúcich vysoké množstvo fenolov, ako sú napríklad listy bavlny, by vstupné množstvo vzorky malo byť striktne nižšie ako 0,4 mg, inak bude ovplyvnená reakcia PCR.
Všetky výrobky je možné prispôsobiť pre ODM/OEM. Podrobnostikliknite na položku Prispôsobená služba (ODM/OEM)
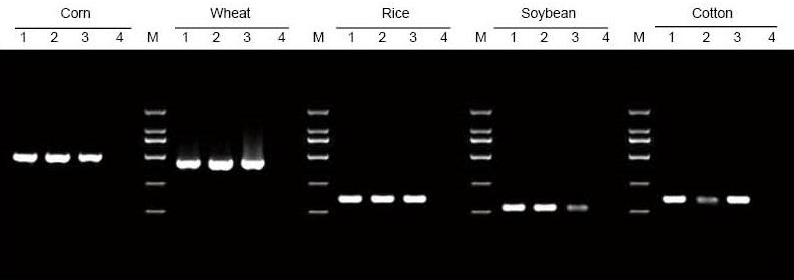 |
DNA sa extrahovala z 5 mg listov a semien kukurice, pšenice, ryže, sóje a bavlny. DNA bola amplifikovaná pomocou PCR s použitím špecifických primérov. Do jedného pruhu bolo nanesených 6 μl DNA z celkových 20 μl eluentov. 1: Pozitívny kontrolný genóm; 2: nechajte vzorky; 3: vzorky osiva; 4: NTC; 5: D2000 priméry |
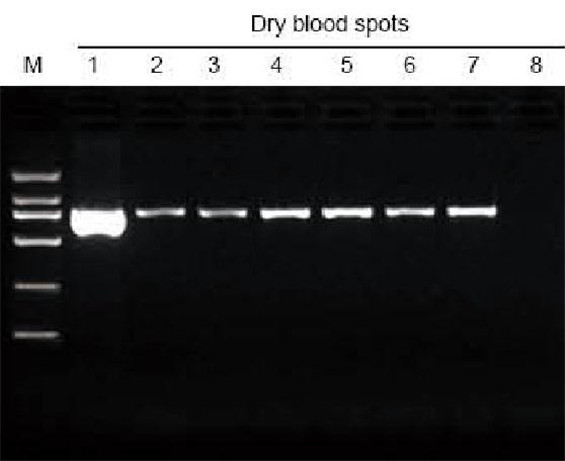 |
M: TIANGEN Marker D2000; 1: Pozitívna kontrola; 2-7: Počet zaschnutých krvných škvŕn na filtračnom papieri je 1-6; 8: Negatívna kontrola. 3 mm dierovač bol použitý na odobratie zaschnutých krvných škvŕn z filtračného papiera ako materiálu na extrakčný test. Do jedného pruhu bolo nanesených 6 μl DNA z celkových 20 μl eluentov. |
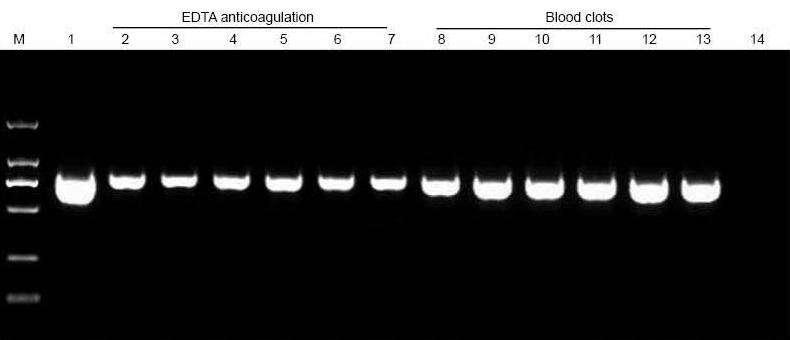 |
M: TIANGEN Marker D2000; 1: Pozitívna kontrola (ako templát bola použitá genómová DNA); 2-7: Množstvo pridanej krvi je 10 μl, 20 μl, 30 μl, 40 μl, 50 μl a 60 μl; 8-13: Množstvo pridanej krvi je 10 μl, 20 μl, 30 μl, 40 μl, 50 μl a 60 μl; 14: NTC. Na agarózový gél bolo nanesených 6 ul DNA z celkových 20 ul eluentov. |
Šablóna A-1
■ Šablóna obsahuje proteínové nečistoty alebo inhibítory Taq, atď. - Purifikujte templát DNA, odstráňte proteínové nečistoty alebo extrahujte templátovú DNA pomocou purifikačných súprav.
■ Denaturácia templátu nie je úplná - —Vhodne zvýšte denaturačnú teplotu a predĺžte denaturačný čas.
■ Degradácia šablóny ——Pripravte šablónu.
A-2 Primer
■ Nízka kvalita primerov-Znovu syntetizujte primer.
■ Degradácia základného náteru --— Kvôli konzervácii rozdeľte priméry s vysokou koncentráciou do malého objemu. Vyhnite sa viacnásobnému zmrazovaniu a rozmrazovaniu alebo dlhodobému zmrazovaniu v 4 ° C.
■ Nesprávny dizajn primerov (napr. Dĺžka primeru nie je dostatočná, dimér vytvorený medzi primermi atď.) -Prepracovať priméry (vyhnite sa tvorbe diméru priméru a sekundárnej štruktúry)
A-3 Mg2+koncentrácia
■ Mg2+ koncentrácia je príliš nízka —— Správne zvýšte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-4 Teplota žíhania
■ Vysoká teplota žíhania ovplyvňuje viazanie základného náteru a templátu. —— Znížte teplotu žíhania a optimalizujte stav s gradientom 2 ° C.
A-5 Čas predĺženia
■ Krátky čas predĺženia —— Predĺžte čas predĺženia.
Javy: Negatívne vzorky tiež ukazujú pásy cieľovej sekvencie.
A-1 Kontaminácia PCR
■ Krížová kontaminácia cieľovej sekvencie alebo amplifikačných produktov ——————————————————————————————————————————————————————————————————————————————————————————————— opatrné opatrenie: vzorku Činidlá alebo zariadenie by sa mali autoklávovať, aby sa odstránili existujúce nukleové kyseliny, a existencia kontaminácie by sa mala určiť pomocou experimentov s negatívnou kontrolou.
■ Kontaminácia reagencií ——Reagenty rozoberte a skladujte pri nízkej teplote.
A-2 Primer
■ Mg2+ koncentrácia je príliš nízka —— Správne zvýšte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
■ Nesprávny dizajn primeru a cieľová sekvencia má homológiu s necieľovou sekvenciou. ——Re-design primerov.
Javy: PCR amplifikačné pásy nie sú v súlade s očakávanou veľkosťou, buď veľké alebo malé, alebo sa niekedy vyskytujú špecifické amplifikačné pásy aj nešpecifické amplifikačné pásy.
Základný náter A-1
■ Slabá špecificita primeru
——Re-design primer.
■ Koncentrácia priméru je príliš vysoká - —Vhodne zvýšte denaturačnú teplotu a predĺžte denaturačný čas.
A-2 Mg2+ koncentrácia
■ Mg2+ koncentrácia je príliš vysoká —— Správne znížte koncentráciu Mg2+: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-3 Termostabilná polymeráza
■ Nadmerné množstvo enzýmu - Množstvo enzýmu primerane znížte v intervaloch 0,5 U.
A-4 Teplota žíhania
■ Teplota žíhania je príliš nízka —— Vhodne zvýšte teplotu žíhania alebo použite dvojstupňovú metódu žíhania
A-5 PCR cykly
■ Príliš veľa cyklov PCR - Znížte počet cyklov PCR.
Základný náter A-1—— Slabá špecifickosť —— Znovu navrhnite základný náter, zmeňte polohu a dĺžku základného náteru, aby ste zvýšili jeho špecifickosť; alebo vykonajte vnorenú PCR.
DNA templátu A-2
——Šablóna nie je čistá —— Purifikujte templát alebo extrahujte DNA purifikačnými súpravami.
A-3 Mg2+ koncentrácia
——Mg2+ koncentrácia je príliš vysoká —— Správne znížte Mg2+ koncentrácia: Optimalizujte Mg2+ koncentrácia sériou reakcií od 1 mM do 3 mM s intervalom 0,5 mM na stanovenie optimálneho Mg2+ koncentrácia pre každý templát a primer.
A-4 dNTP
——Koncentrácia dNTP je príliš vysoká —— Znížte vhodne koncentráciu dNTP
A-5 Teplota žíhania
—— Príliš nízka teplota žíhania —— Vhodne zvýšte teplotu žíhania
A-6 Cykly
——Príliš veľa cyklov ——Optimalizujte počet cyklov

Prvým krokom je výber vhodnej polymerázy. Bežná Taq polymeráza nemôže byť skontrolovaná kvôli nedostatku aktivity 3'-5 'exonukleázy a nesúlad výrazne zníži účinnosť predĺženia fragmentov. Bežná Taq polymeráza preto nemôže účinne amplifikovať cieľové fragmenty väčšie ako 5 kb. Taq polymeráza so špeciálnou modifikáciou alebo iná vysoko verná polymeráza by mala byť zvolená tak, aby sa zlepšila účinnosť extenzie a splnili potreby amplifikácie dlhých fragmentov. Okrem toho amplifikácia dlhých fragmentov tiež vyžaduje zodpovedajúcu úpravu konštrukcie priméru, času denaturácie, času predĺženia, pH pufra atď. K lepšiemu výťažku môžu obvykle viesť priméry s 18 až 24 bp. Aby sa zabránilo poškodeniu templátu, denaturačný čas pri 94 ° C by sa mal skrátiť na 30 sekúnd alebo menej na cyklus a čas na zvýšenie teploty na 94 ° C pred amplifikáciou by mal byť kratší ako 1 minúta. Efektívnu amplifikáciu dlhých fragmentov môže zaistiť aj nastavenie teploty predĺženia na približne 68 ° C a návrh času predĺženia podľa rýchlosti 1 kb/min.
Chybovú rýchlosť amplifikácie PCR je možné znížiť použitím rôznych DNA polymeráz s vysokou vernosťou. Spomedzi všetkých doposiaľ nájdených Taq DNA polymeráz má enzým Pfu najnižšiu chybovosť a najvyššiu vernosť (pozri priloženú tabuľku). Okrem výberu enzýmov môžu vedci ďalej znižovať rýchlosť mutácií PCR optimalizáciou reakčných podmienok vrátane optimalizácie zloženia pufra, koncentrácie termostabilnej polymerázy a optimalizácie počtu cyklov PCR.
Kategórie produktov
PREČO SI VYBRAŤ NÁS
Od svojho založenia naša továreň vyvíja prvotriedne výrobky s dodržaním tohto princípu
najskôr kvality. Naše výrobky získali vynikajúcu povesť v tomto odvetví a dôveryhodnosť medzi novými a starými zákazníkmi.








